定 比例 の 法則 わかり やすく
windows10 ドライブ の スキャン および 修復 中 進ま ない【1分でわかる】定比例の法則を具体例でわかりやすく解説 . 生理 周期 短く なっ た 30 代 妊娠
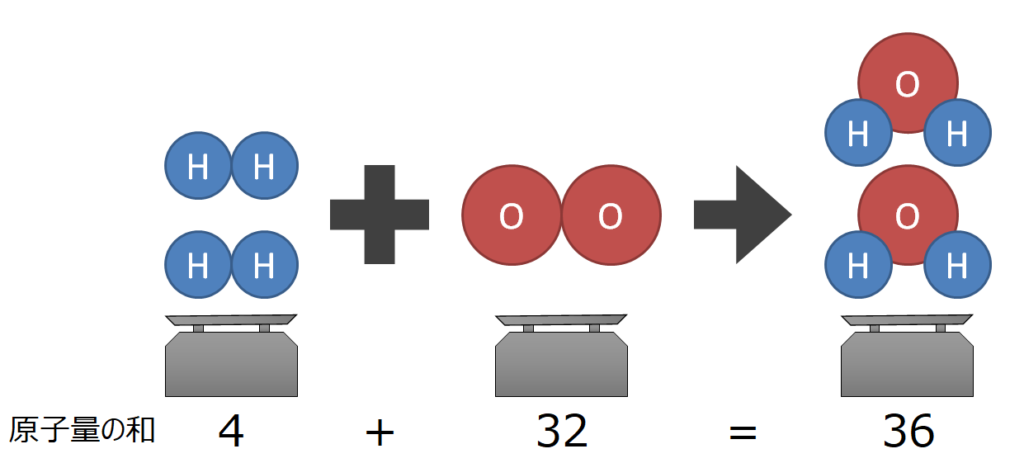
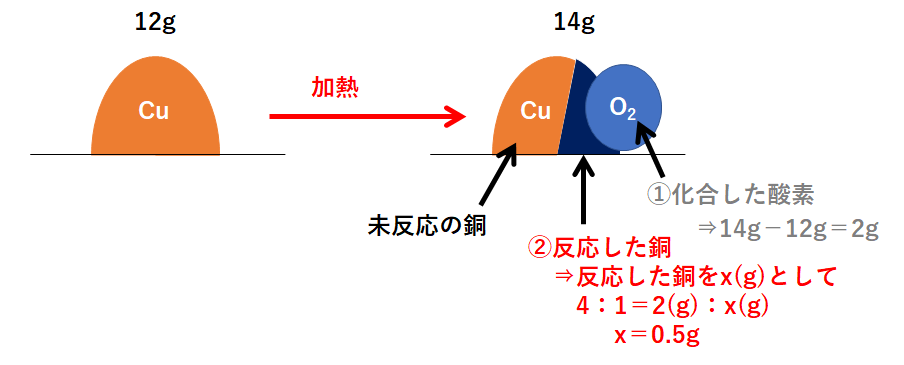
ニュー 代々木 マンション定比例の法則 とは、 「ある化合物を構成する成分元素の質量比は、その製法の如何を問わず、常に一定である。 」 というものです。 本記事では、その具体例を解説します。. 定比例の法則を例を出してわかりやすく歴史に沿ってまとめて . 化学の基本法則の1つのプルーストが提唱した定比例の法則を解説します。多くの人は、これを倍数比例の法則と勘違いします。かなり法則自体似ていますから。なので、これらの区別がバッチリつく方法や具体例で一見ピンとこない定比例の. 【定比例の法則】未反応の問題・混合物の問題をわかりやすく . 定比例の法則 とは,物質が化学反応するとき,反応する物質の質量の割合は一定 である法則です. 例えば,上の青色のグラフは,銅の加熱前と加熱後の質量を表しています. 銅の質量が1.2gのとき,加熱後には1.5gになっています.. 【3分でわかる】定比例の法則と倍数比例の法則の違いと覚え方 . 混同しやすい定比例の法則と倍数比例の法則の2種類の違いは理解できていますか? 定比例の法則 とは、 「ある化合物を構成する成分元素の質量比は,その製法の如何を問わず,常に一定である。. 定比例の法則を具体例でわかりやすく解説 | ViCOLLA Magazine. 定比例の法則 とは、 「ある化合物を構成する成分元素の質量比は,その製法の如何を問わず,常に一定である。. 」 というものです。. 【例】. 例えば、炭素を燃焼させてできる二酸化炭素も,動物の呼吸中に含まれる二酸化炭素も,炭素と酸素の質量比は3 . 中2化学【定比例の法則(酸化)】 | 中学理科 ポイントまとめと . 1.定比例の法則. 定比例の法則. 物質どうしが反応する質量比はいつでも一定であること。. 物質どうしの反応する質量比はいつでも決まっています。. たとえば銅の酸化の場合、銅と酸素は必ず4:1の質量比で反応します。. また水素が燃焼して水になる場合 . 化学の基本相法則まとめ(質量保存・定比例・原子説・倍数 . 定比例の法則. 「同じ化合物であれば、その作られ方によらず、化合物を構成する成分元素の質量比は常に一定である」という法則を定比例の法則といいます。 この法則は、1799年にプルーストによって発見されました。 ここでは、二酸化炭素を例に説明していきましょう。 二酸化炭素は炭素原子 ( C ) 1個と酸素原子 ( O ) 2個で形成されています。 二酸化炭素の質量と二酸化炭素に含まれる炭素の質量の関係をグラフで表すと,次のようになります。 炭素の質量が12の時、二酸化炭素の質量は44になっています。 また、二酸化炭素の質量から炭素の質量を引くと酸素の質量は32とわかります。 ここから、炭素・酸素・二酸化炭素の質量の比は (「12:32:44」=「3:8:11」) となります。. 化学の基本法則(定比例・倍数比例・アボガドロ・質量保存 . 参考:定比例の法則(発見者・例・グラフ・硫酸銅の問題の解き方など) 倍数比例の法則 A、Bの2元素から成る化合物が2種類以上あるとき、一定量のAと化合しているBの質量はこれらの化合物の間で簡単な整数比が成り立つ。. 化合物内における元素の質量組成「定比例の法則」を元塾講師 . この記事の目次. 1.昔と今の認識の違い. 1-1.化学の基礎知識. 1-2.正確な実験の難しさ. 長谷川 るい の 極上 筆 おろし
病気 に 強い ブドウ 品種2.「定比例の法則」とは. 2-1.どこで採っても水は水. 2-2.同じ物質であるということ. 2-3.物質の成分元素における質量組成比. 3.実験で証明. 定比例の法則(発見者・例・グラフ・硫酸銅の問題の解き方 . 定比例の法則とは. 同じ1つの化合物では、その成分元素の質量組成は常に一定である。 この法則を 定比例の法則 という。 このページでは、例として酸化銅 (Ⅱ)を使って解説する。 酸化銅 (Ⅱ)は銅Cu原子1個と酸素O原子1個で形成されている。 酸化銅 (Ⅱ)の質量と酸化銅 (Ⅱ)に含まれる銅の質量の関係をグラフで表すと次のようになる。 このグラフにおいて、銅の質量が64のとき、酸化銅 (Ⅱ)の質量は80になっている。 また、酸化銅 (Ⅱ)の質量から銅の質量を引くと酸素の質量も16と求めることができる。 ここから、銅・酸素・酸化銅 (Ⅱ)の質量の比は「64:16:80」=「4:1:5」となる。 次に、銅の質量が128のときを考える。 グラフから酸化銅 (Ⅱ)の質量は160だとわかる。. 【完全版】倍数比例の法則・定比例の法則・気体反応の法則 . 定比例の法則 とは、 「ある化合物を構成する成分元素の質量比は,その製法の如何を問わず,常に一定である。 」 というものです。 定比例の法則の発見者はジョゼフ・ルイ・ プルースト であり、発見した年は1799年です。 詳細は 定比例の法則を具体例でわかりやすく解説 を参照してください。 質量保存の法則とは. 参照: a.wikipedia.org/wiki/%E3%82%A2%E3%83%B3%E3%83%88%E3%83%AF%E3%83%BC%E3%83%8C%E3%83%BB%E3%83%A9%E3%83%B4%E3%82%A9%E3%82%A2%E3%82%B8%E3%82%A8. 質量保存の法則 とは、 「化学反応の前後において,物質の総質量は変化しない。. 定比例の法則 - Wikipedia. 定比例の法則(ていひれいのほうそく、英: law of definite proportions/law of constant proportions )とは、物質が化学反応する時、反応に関与する物質の質量の割合は、常に一定であるという法則。. 化学反応式の基本法則を押さえよう!質量保存の法則と定比例 . 定比例の法則 :1つの化合物を構成する元素の質量比は常に一定. 倍数比例の法則 :2種類以上の元素 (例えば元素AとB)がいくつかの異なる化合物を作るとき、一定質量の元素Aと元素Bの質量の間には簡単な整数比が成り立つ. アボガドロの法則 :気体の種類に関係なく、同一温度、同一圧力下では同じ体積中に同じ数の分子を含む. Mt.フジ. 今回は、化学反応式の基本的な法則を解説します. クリックできる目次. 質量保存の法則. 定比例の法則. 倍数比例の法則. アボガドロの法則. 質量保存の法則とは 《化学反応前後の質量の総和は等しい》 という法則です。 質量は原子量の総計になるということと、 化学反応では原子は消失したり新たに生成されたりしない 、ということを理解していれば理解は容易いかと思います。. 定比例の法則とは何ですか? - Greelane.com. 定比例の法則 は、倍数比例 の 法則とともに、 化学における化学 量論の研究の 基礎を形成します 。 定比例の法則は、プルーストの法則または一定の構成の法則としても知られています。 定比例の法則の定義. 定比例の法則は、 化合物 のサンプルには常に同じ 質量の 元素 が含まれると述べています 。 元素の質量比は、元素がどこから来たのか、化合物がどのように調製されたのか、またはその他の要因に関係なく固定されています。 基本的に、法則は、特定の元素の原子がその元素の他の原子と同じであるという事実に基づいています。 したがって、酸素の原子は、それがシリカに由来するか空気中の酸素に由来するかにかかわらず、同じです。. 定比例の法則 - Wikiwand. 定比例の法則 (ていひれいのほうそく、 英: law of definite proportions/law of constant proportions )とは、物質が 化学反応 する時、反応に関与する 物質 の 質量 の割合は、常に一定であるという 法則 。 また化学反応において 元素 の転換は起こらないので、これは 化合物 を構成する成分元素の質量の比は常に一定であることも意味する。 例えば 水 を構成する 水素 と 酸素 の質量の比は常に1:8である( 1 H と 16 O のみを考えた場合)。 他の例としては、 酸化銅 (II) を構成する 銅 と酸素の質量の比が常に4:1であることなどがある。. 定比例の法則(テイヒレイノホウソク)とは? 意味や使い方 . law of definite proportions. 一つ の化合物に含まれる成分元素の質量の比はつねに一定であるという法則で,1799年J.L.プルーストにより見いだされた。 この法則が成り立つのは, 原子量 の一定な成分元素がつねに一定の原子数の比で化合物をつくるからである。 たとえば,水を構成している水素と酸素の質量比が1.008:8.00になるのは,原子量1.008の 水素原子 と原子量16.00の酸素原子が,つねに2:1の 割合 で結合して水ができるからである。 天然における 同位体 の存在比が変動して見かけの原子量が変わると,化合物の成分元素の質量の比が変わることがあるが,このとき結合する原子数の比は変わらない。. 定比例の法則 - ウィキバーシティ. 定比例の法則 は、「化合物の中では、成分元素の質量比はつねに一定である」という法則。 1799年、フランスのJ・L・プルーストによって提出されたものである。 概要 [ 編集] ある化合物についてみると、成分元素の質量比は、製法や産出地などによらずつねに一定になるという。 化合物の化学組成、あるいは化学変化における物質の数量的関係を対象とするのは化学量論(ストイキオメトリー)である。 たとえば、水では水素と酸素の質量比は1対8(厳密には1対7.9396)である。 その他 [] 定比例の法則は提案された当時、激しい反対にあったことは有名である。 反対の急先鋒 (せんぽう)は、当時のフランス化学会の長老、C・L・ベルトレであった。. 2-2.「定比例の法則」で質量比を考える - Study-Z ドラゴン桜と . これが定比例の法則です。 (ここでは下記で比較しやすいように約分はしていませんが、簡単な整数比になるよう約分できますよね。 2-3.同元素を含む異なる物質について考える. image by iStockphoto. それではここから考えを広げてみます。 炭素原子の質量を12としたとき、これと結びつく酸素の質量は 一酸化炭素では16 、 二酸化炭素では32 です。 それぞれの場合の酸素の質量は 16:32 、つまり 1:2 という簡単な整数比で表すことができます。 同様に一酸化窒素と二酸化窒素では窒素と結びつく酸素の比は 1:2 になり、水と過酸化水素では水素と結びつく酸素の比が 1:2 となりますね。. 宮島 の だんまり
三 峯 神社 不思議 な 体験化合物内における元素の質量組成「定比例の法則」を元塾講師 . 大前提として「定比例の法則」は 同一の化合物 について述べたものであると理解しましょう。 先述したように、同じ物質であるということは 同じ組成式 (化学式)で表すことができる はずです。 水は H 2 O であり、OH や H 2 O 2 とはなりませんよね。 (ただし、このような分子や組成式という考え方もこの法則が生まれたのちにわかったことです。 また、雨水や海水のように様々な化合物や単体が混ざり合った混合物の場合も、今回の法則で扱うことができるのは化合物のみであることを理解しましょう。 2-3.物質の成分元素における質量組成比. 物質の成分元素における質量組成比について、わかりやすく水で考えていきましょう。. 定比例の法則(ていひれいのほうそく)とは? 意味・読み方 . 定比例の法則(ていひれいのほうそく)とは? 意味・読み方・使い方をわかりやすく解説 - goo国語辞書. 辞書. 国語辞書. 物理・化学の言葉. 「定比例の法則」の意味. 定比例の法則( ていひれいのほうそく ) とは? 意味・読み方・使い方. ブックマークへ登録. 意味. 例文. 慣用句. 画像. ていひれい‐の‐ほうそく〔‐ハフソク〕【定比例の法則】 の解説. 化合物 の 成分 元素 の質量比は常に一定であるという 法則 。 1799年、J=L=プルーストが 発見 。 この 法則 に従うものは 定比化合物 、従わないものは 不定比化合物 とよばれる。 出典: デジタル大辞泉(小学館) 定比例の法則 のカテゴリ情報. 出典: デジタル大辞泉(小学館) #物理・化学の言葉. #名詞. 定比例の法則 - 歴史 - わかりやすく解説 Weblio辞書. 定比例の法則は ドルトン が 原子論 を提唱する際にその根拠の1つとして発表され受け入れられていった。 しかし、金属間化合物や一部の金属酸化物ではベルトレーの主張したような成分元素の比がある範囲で変化するものも知られており、 不定比化合物 あるいは ベルトレー の名をとってベルトライド化合物と呼ばれている。 それに対し定比例の法則に従い、特定の組成しかとらない化合物は、定比化合物あるいは ドルトン の名をとってドルトナイド化合物と呼ばれている。 その後. 定比例の法則も 倍数比例の法則 も受け入れられるようになっていったが、ドルトンの 原子論 では、どうしても都合がつかないような状況が生じてくるようになってきた。 それが 気体反応の法則 である。. 【3分でわかる】倍数比例の法則を具体例でわかりやすく解説 . 倍数比例の法則 とは、 「2種類の元素AとBが化合して,いくつかの異なる化合物を作るとき,一定質量のAとBの質量の間には,簡単な整数比が成り立つ。 」 というものです。 【例】 例えば、一酸化炭素28 gと二酸化炭素44 gは、それぞれ同量の炭素12 gを含んでいます。 (炭素の原子量C = 12 、酸素の原子量O = 16) 一酸化炭素28 g中の酸素は 16 g であり、二酸化炭素44 g中の酸素は 32 g となります。 つまり、 一定量の炭素を含む一酸化炭素と二酸化炭素それぞれに含まれる酸素の質量の比は、1:2 という比 で表されます。 これが倍数比例の法則です。. 定比例の法則とは何? わかりやすく解説 Weblio辞書. 定比例の法則 (ていひれいのほうそく、 英: law of definite proportions/law of constant proportions )とは、物質が 化学反応 する時、反応に関与する 物質 の 質量 の割合は、常に一定であるという 法則 。 また化学反応において 元素 の転換は起こらないので、これは 化合物 を構成する成分元素の質量の比は常に一定であることも意味する。 例えば 水 を構成する 水素 と 酸素 の質量の比は常に1:8である( 1 H と 16 O のみを考えた場合)。 他の例としては、 酸化銅 (II) を構成する 銅 と酸素の質量の比が常に4:1であることなどがある。 脚注. [ 続きの解説] 「定比例の法則」の続きの解説一覧. 1 定比例の法則とは. 万有引力の法則ってなに?わかりやすく解説 | 受験物理ラボ. ケプラーの法則ってなに?. わかりやすく解説. あらゆる物体の間に働く引力を万有引力と呼びます。. 万有引力はありとあらゆる物体に働き、それぞれの質量の積に比例し、距離の2乗に反比例するということがわかっていますが、実際にこの万有引力の公式 . 比例(数学)の意味を分かりやすく解説 - 具体例で学ぶ数学. 数式による説明で登場した式 y = ax y = a x の a a を比例定数と言います。. お肉の例では比例定数は 2.5 2.5 でした。. 比例定数が負になるような場合もあるので、そのような具体例を紹介します。. 例2:最近雨が降らず、毎日 2cm 2 c m ずつ川の水位が減少して . 4つの化学の基本法則|原子説・分子説の周辺を総まとめ | 合格タクティクス. 化学の基本法則 の発見と, 原子説 ・ 分子説 の時代的な流れは. 質量保存の法則(ラボアジエ). 定比例の法則(プルースト). 原子説(ドルトン). 倍数比例の法則(ドルトン). 気体反応の法則(ゲーリュサック). 分子説(アボガドロ). 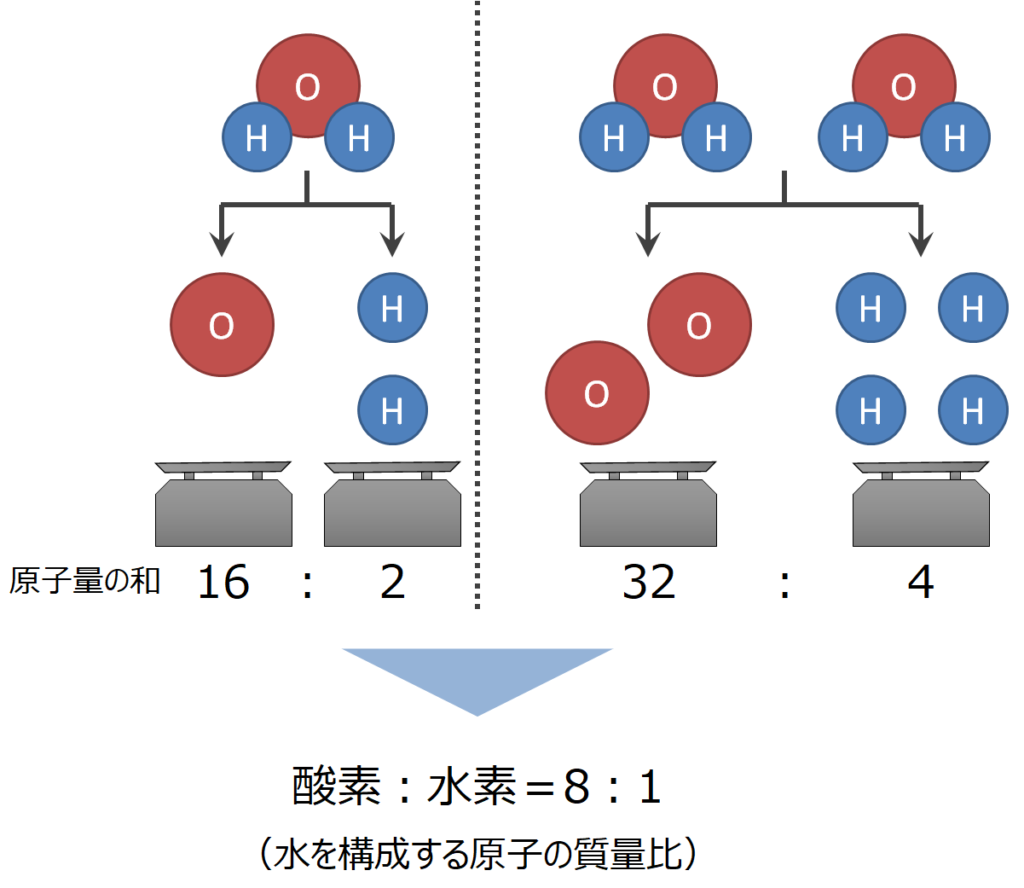
月 の 丘 とめ さん 家フックの法則をわかりやすく解説! 【中学 理科】|かめのこブログ. フックの法則とは. 「フックの法則」とは、「ばねの伸びる長さ」 は 「ばねに加わる力の大きさ」に比例するという法則のことです。. ここでいう「ばね」というのは、下の図のような普通のばねのことです。. 日常の生活では、あまり見かけることがない . カイ二乗検定とは?わかりやすく例で分割表の検定の計算式も簡単に!|いちばんやさしい、医療統計. カイ二乗検定を例を用いてわかりやすく解説! では実際に、例を挙げてカイ二乗検定でやっていることを簡単にわかりやすく説明します。 例えば、こんな分割表があったとします。 表1:薬剤群とコントロール群で治った人の数. ボイルシャルルの法則ってなに?わかりやすく解説 | 受験物理ラボ. わかりやすく解説. ボイルシャルルの法則は「一定量の気体の体積は気体の圧力に比例し、温度に反比例する」ことを表しています。. ボイルシャルルの法則はその名前の通り「ボイルの法則」と「シャルルの法則」を組み合わせた法則です。. それぞれの式 . クーロンの法則!公式と問題もわかりやすく解説! | Dr.あゆみの物理教室. クーロンの法則の公式は、必ず覚えておきましょう! ところで、テキストによっては、クーロンの法則が絶対値をつけない形で書かれていますね。 絶対値をつけないと、2つの電荷が異符号なら f <0で引力、同符号なら f >0で斥力を表すのでしょうが・・・、. 定比例の法則と倍数比例の法則の違い | ViCOLLA Magazine. 混同しやすい定比例の法則と倍数比例の法則、気体反応の法則の3種類の違いについてわかりやすく解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。. 「ビオ=サバールの法則」を理系大学生がガチでわかりやすく解説! - Study-Z. ビオ=サバールの法則って知ってるか? 電磁気学の法則で小中はもちろん高校でもなかなか取り上げられない法則なのですが、大学では頻繁に使う法則で電気と磁気を結びつける大切な法則なんです。ビオ=サバールの法則を理解するためには電流素片や磁場の知識も必要になるのでこの記事で . 【ギブス自由エネルギー】をわかりやすく解説:閉鎖系の自発変化の方向や平衡状態を表現 - 化学工学レビュワー. ゲームボーイ アドバンス の ソフト を 遊び たい
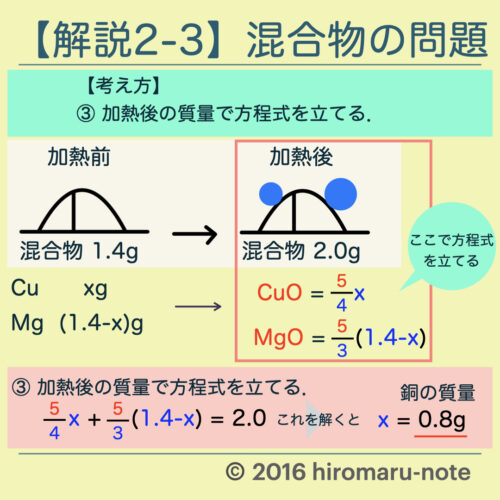
猫 と 泊まれる ホテル 関西 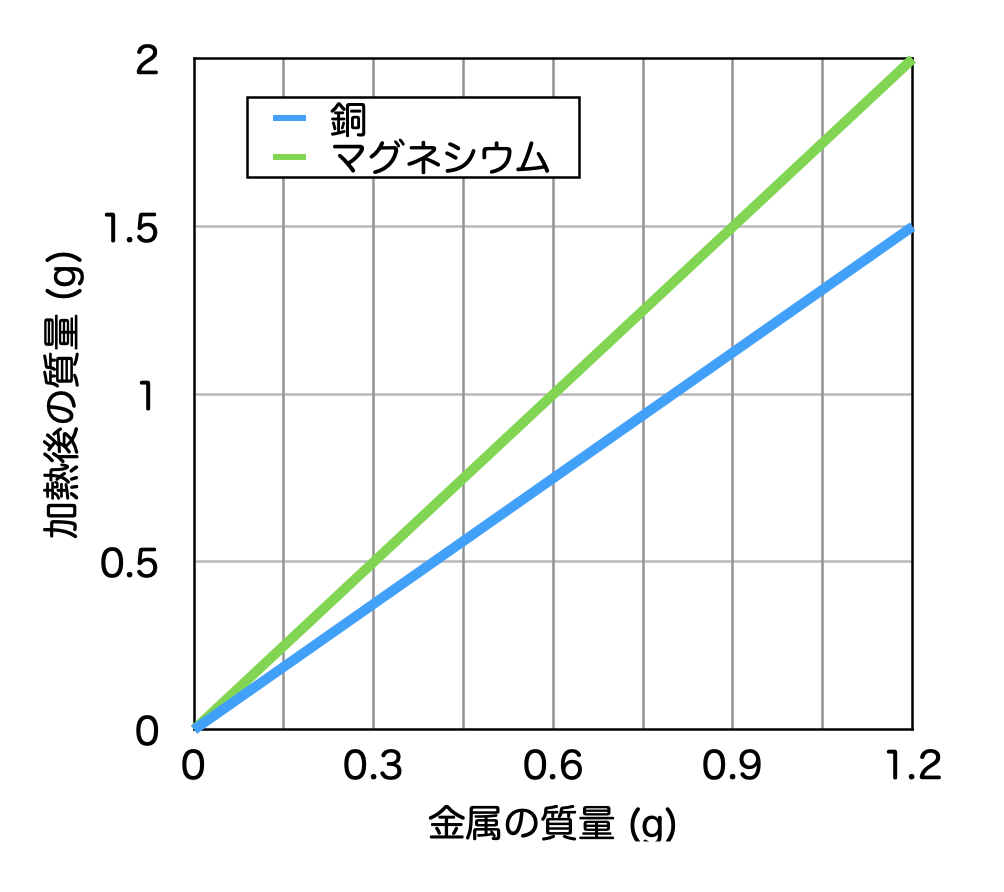
漢字 を ローマ字 に 変換ただしこれらの法則では、物質と . 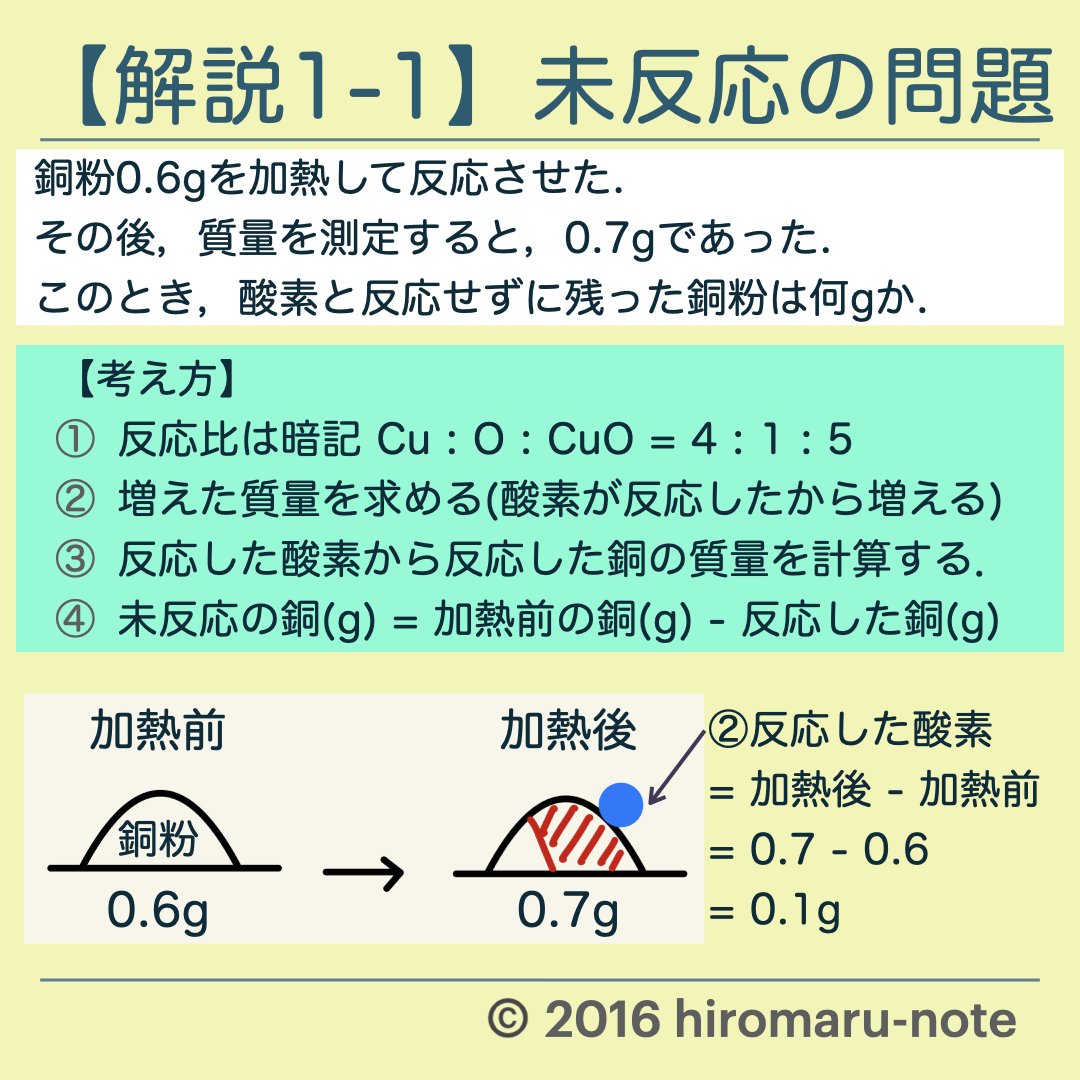
スポーツ 奨学生 と はよって次の式が建てられます。. つまり、体積を小さくすれば圧力は高くなるし、体積を大きくすれば . 歯 溝 の 振れ
じん ちゅう 鼻 の 下ヘンリーの法則をわかりやすく解説! │ 受験メモ. 溶媒に溶ける気体の物質量は圧力に比例する という法則です。. 短い言葉で言えば、. 押した分だけ溶ける. 
天秤座 と 牡 牛 座 の 相性この様な問題で導線の動く向きを間違える人が非常に多いです。. これを間違えるだけで試験の点数は大きく変わります。. 間違いを . 屈折の法則「スネルの法則」を理系ライターがわかりやすく解説 - Study-Z. 今回は屈折の法則として知られる「スネルの法則」について考えてみよう。 この屈折の法則は波の法則だから、音波はもとより光波についても成立しているんです。つまり物理学では「波」というものについての一般化を行っているのさ。 波を理解すれば、音であろうが光であろうがその他の . 角速度の求め方は?公式や単位をわかりやすく解説!ω, v, r の関係は?|高校生向け受験応援メディア「受験のミカタ」. 角速度とは何か?公式と求め方、角速度と速さ・円の半径との関係、単位についてを物理が苦手でも角速度が理解できるように、わかりやすく解説しています。角速度ω・速さvを求める計算問題もありますので、是非挑戦してみてください。. 気体反応の法則とは?原子説との矛盾点もわかりやすく解説しみた | 化学受験テクニック塾. 化学基礎 2018.08.24 2023.07.17. 気体反応の法則とは?. 原子説との矛盾点もわかりやすく解説しみた. 気体反応の法則は、基本法則の中でかなり出題頻度は高い方です。. それは、原子説の矛盾を突き止めるきっかけになった法則だからです。. 新年 会 の お知らせ テンプレート
入試問題では . [小6]比例と反比例|意味とグラフをわかりやすく解説 | 数学のトムラボ.